CÁNCER
La nueva generación de antitumorales eficaces en las células más resistentes
Los investigadores tratan de desarrollar terapias de nueva generación, como los inhibidores de mTOR de tercera generación sin esperar a que los pacientes desarrollen resistencia a las terapias más recientes
Investigadores de EE.UU. han diseñado una potencial terapia contra el cáncer que utiliza una estrategia única para bloquear mTOR, una molécula que ayuda a impulsar el crecimiento de muchos cánceres. En experimentos con animales, el fármaco ha logrado reducir el tamaño de los tumores que son resistentes a generaciones anteriores de inhibidores de mTOR. El trabajo, publicado en « Nature », ha sido dirigido por Kevan Shokat, de la Universidad de California en San Francisco , y Neal Rosen, del Memorial Sloan Kettering Cancer Center .
Noticias relacionadas
Muchos fármacos para el cáncer intentan bloquean mTOR, una parte clave de una red de reguladores del crecimiento, que a menudo se interrumpe en las células cancerosas. El más antiguo de estos fármacos, la rapamicina y moléculas relacionadas llamadas rapálogos, han logrado cierto éxito en el tratamiento de algunos tipos de cáncer, incluyendo el de riñón y de mama. Actualmente, se están evaluando en ensayos clínicos inhibidores de mTOR de segunda generación. Por desgracia, los tumores pueden volverse resistentes a los rapálogos después de meses o años de tratamiento eficaz y es probable que también se desarrolle resistencia a los inhibidores de mTOR de segunda generación.
Resistencias
Uno de los problemas de los tratamientos moleculares para el cáncer es que algunas células tumarles acaban volviéndose resistentes. Por eso, los investigadores tratan de desarrollar terapias de nueva generación, como los inhibidores de mTOR de tercera generación sin esperar a que los pacientes desarrollen resistencia a las terapias más recientes.
Para anticipar cómo podría surgir la resistencia, el equipo de Rosen expuso células derivadas de cáncer de mama que crecieron en el laboratorio a rapamicina o un inhibidor de mTOR de segunda generación, ADZ8055, durante tres meses. La mayoría de las células murieron, pero como era de esperar, algunas encontraron una manera de sobrevivir y multiplicarse.
Los investigadores examinaron las células resistentes a los fármacos para identificar los cambios específicos que habían permitido que prosperaran, razonando que los mismos cambios pueden surgir en pacientes que recibieron los medicamentos. A continuación, los científicos buscaron las mutaciones en bases de datos genéticos que catalogan los tumores de pacientes con cáncer.
Uno de los problemas de los tratamientos moleculares para el cáncer es que algunas células tumarles acaban volviéndose resistentes
Para su sorpresa, las mutaciones que habían sufrido sus células cultivadas en el laboratorio resistentes a ADZ8055 estaban presentes en los tumores de algunos pacientes incluso antes del tratamiento. « Eso realmente fue un shock, porque por lo general son mutaciones inducidas por los fármacos », dice Shokat. Los cambios, presentes en aproximadamente el 10% de los tumores de células renales (el tipo más común de cáncer de riñón), impulsaron la actividad de mTOR, lo que significaba que ayudaron al crecimiento del tumor con o sin ADZ8055.
Los pacientes cuyos tumores portaban las mutaciones no responderían al inhibidor de mTOR de segunda generación, dice Shokat. «Inmediatamente, el proyecto cambió de 'los pacientes tendrán estas mutaciones, por lo que vamos a necesitar un medicamento' a 'los pacientes ya tienen estas mutaciones, y son de nuevo resistentes al fármaco que tenemos en la clínica'», relata.
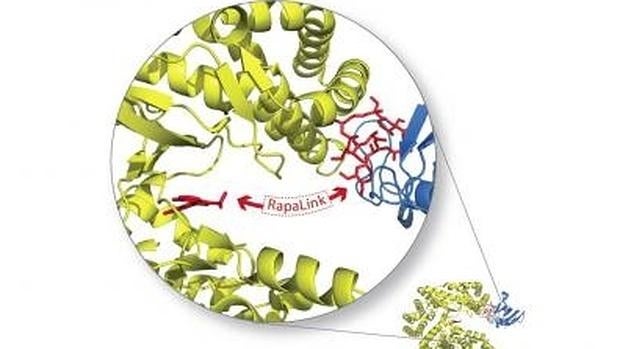
Los investigadores sabían que necesitaban un inhibidor de mTOR que funcionara de manera diferente a sus predecesores. Para ello, Shokat se inspiró en el sistema inmunológico. Los anticuerpos tienen éxito en unirse a objetivos en rápida evolución, gracias a su estructura en forma de Y con dos puntas de unión al antígeno . Los dos sitios de unión de los anticuerpos le proporcionan fuerte afinidad con sus objetivos, según Shokat, quien quiso imitar la estrategia mediante la creación de un inhibidor que se una a mTOR en dos lugares.
Rapalink
Lo hizo mediante la vinculación de un inhibidor de mTOR de primera generación, que se une a una parte de la molécula, a un inhibidor de segunda generación, que se dirigie a un lugar separado cercano. El nuevo inhibidor, llamado Rapalink, se agarra a mTOR en ambos puntos, y se une mejor que los inhibidores de generaciones anteriores.
Los científicos demostraron que Rapalink puede llegar dentro de las células cancerosas y apagar mTOR
Incluso, el inhibidor de dos puntas puede unirse a mTOR, aunque contenga mutaciones que impiden la unión de los inhibidores más simples. Esto se debe a que no es esencial que ambos sitios de unión de mTOR sean un complemento perfecto para el fármaco. Shokat explica: «Una vez que un lado del inhibidor se ha aferrado a su objetivo, su otro extremo está atado cerca del propio bolsillo de unión y, por lo tanto, es probable que se agarre también».
Los científicos demostraron que Rapalink puede llegar dentro de las células cancerosas y apagar mTOR, incluso si esas células son resistentes a los inhibidores de la generación anterior. También probaron la capacidad de Rapalink para inhibir el crecimiento del tumor en experimentos en animales y vieron que reducía el tamaño de los tumores que eran resistentes a inhibidores de mTOR de primera o segunda generación. « Funcionó de maravilla », afirma Shokat.