Descubren cómo se forman rápidamente las placas amiloides en el alzhéimer
Una investigación sugiere que es posible controlar este proceso que lleva a la demencia
Estamos hechos de proteínas. Pero a diferencia de lo que ocurre con el material genético, estos "ladrillos de la vida" necesitan una maquinaria celular compleja para construir nuestros cuerpos . Aunque su ensamblaje está sometido a control , algunas formas muy comunes de proteínas pueden producir filamentos lineales por un proceso de autoensamblaje. Estas estructuras ampliamente difundidas en la naturaleza dan lugar a estructuras como el "esqueleto" de las células o "citoesqueleto", por ejemplo. Sin embargo, una vez formadas, estas proteínas se limitan a cumplir con su función biológica, pero no promueven directamente la formación de nuevas proteínas.
Aunque la capacidad de autorreplicación está reservada a moléculas más relevantes, como el ADN que constituye el material genético, ciertas proteínas sorprendentemente logran replicarse sin ninguna ayuda. Es lo que ocurre con con los priones, causantes de la enfermedad de las vacas locas. Pero no son las únicas que escapan al control de la maquinaria celular y producen enfermedades.
Esa tendencia a autorreplicarse es una característica que pueden presentar las proteínas capaces de autoensamblarse. Es lo que ocurrre en patologías como la anemia falciforme, o en la formación de fibrillas de amiloide. Estás últimas, están asociadas a enfermedades neurodegenerativas como el alzhéimer (proteínas beta amiloide) o la enfermedad de Parkinson (α-sinucleína) y también a enfermedades como la diabetes tipo II (donde el péptido amiloide se acumula en los islotes productores de insulina del páncreas).
Curiosamente todas estas estructuras son capaces de promover su replicación bajo ciertas condiciones. Y ahora investigadores de Cambridge han identificado el mecanismo que conduce a la rápida acumulación de las proteínas aberrantes tales proteínas, causantes, por ejemplo, de las "placas" amiloides características de la enfermedad de Alzheimer. Y, lo que es más importante, han demostrado que es posible controlar este proceso. Lo publican en "Nature Physics "
La formación espontánea de las primeras fibras amiloides es muy lenta , y por lo general lleva varias décadas , lo que podría explicar por qué el alzhéimer es generalmente una enfermedad que afecta a las personas en su vejez. Sin embargo, una vez que se forman las primeros fibrillas, comienzan a replicarse y propagarse mucho más rápidamente por sí mismas , haciendo la enfermedad extremadamente difícil de controlar. "Uno de los misterios de la formación de las placas de amiloide es cómo, después de su lento periodo de formación inicial, la velocidad de su progresión se vuelve mucho más rápido. Hemos identificado los factores que permiten que el sistema pueda gobernar su propia actividad, convirtiéndose en un proceso fuera de control ", explica Andela Saric , del Departamento de Química de la Universidad de Cambridge, y primera firmante del estudio.
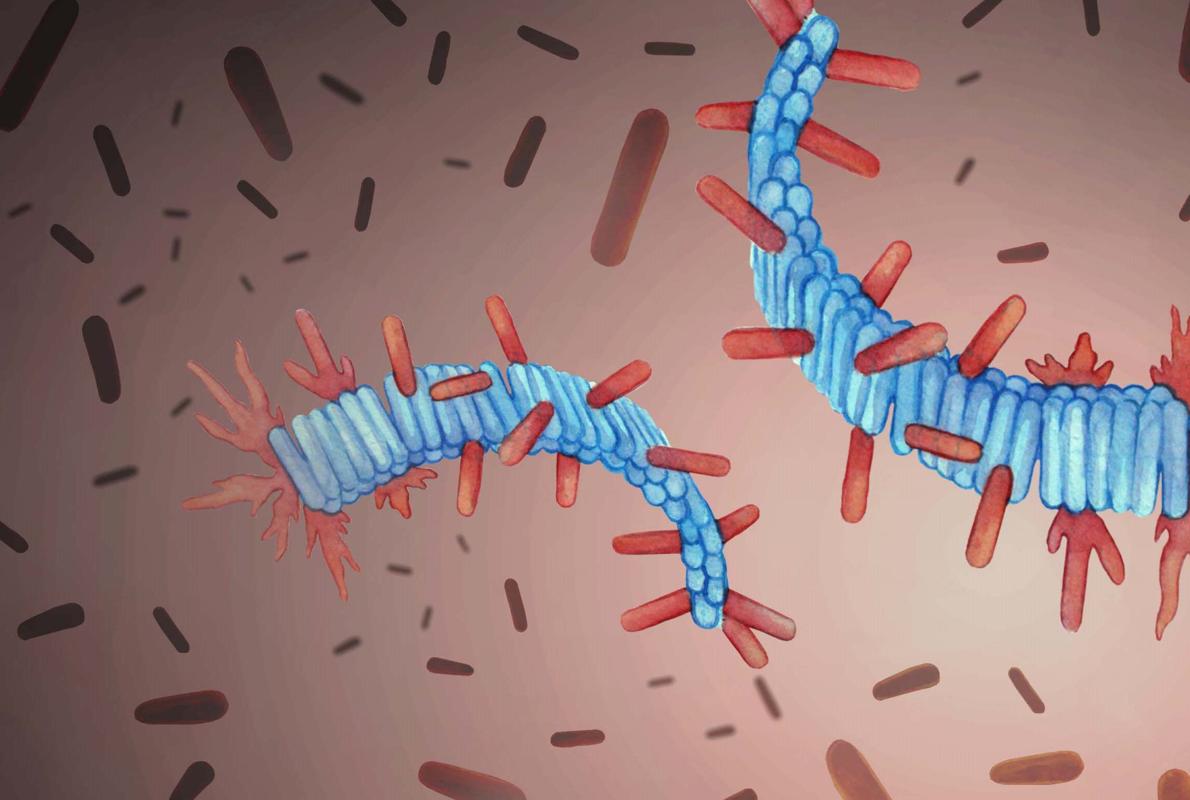
Gracias a la combinación de simulaciones por ordenador y experimentos de laboratorio para identificar los requisitos necesarios para la autorreplicación de las fibrillas de proteína, los investigadores de Cambridge han visto que el proceso aparentemente complicado de autorreplicación de esas fibrillas anómalas se rige en realidad por un simple mecanismo físico : la acumulación de proteínas normales en la superficie de las fibrillas anormales ya existentes.
Esas fibras amiloides anómalas se entrelazan y enredan entre sí, dando lugar a las denominados "placas" amiloides que se detectan en el cerebro de pacientes con alzhéimer. Los investigadores utilizaron la proteínas beta-amiloide, el componente principal de esas placas, para averiguar que hay una relación entre la cantidad de proteínas sanas que se depositan sobre las fibrillas existentes y la velocidad de autorreplicación . En otras palabras, cuanto mayor es la acumulación de proteínas sanas, más rápido se extienden las placas.
También mostraron que cambiando la forma en que las proteínas normales interactúan con la superficie de las fibrillas patológicas es posible controlar la formación de las placas . "Este descubrimiento sugiere que si somos capaces de controlar la acumulación de proteínas normales en las fibrillas, sería posible limitar la agregación y propagación de las placas amiloides", resalta Andela Saric.