“Apagar y encender” el cromosoma X es fundamental para el desarrollo de los ovocitos
Las células germinales que no lograron inactivar el cromosoma X en primer lugar o lo reactivaron demasiado rápido mostraron patrones anormales de expresión génica y diferenciación celular
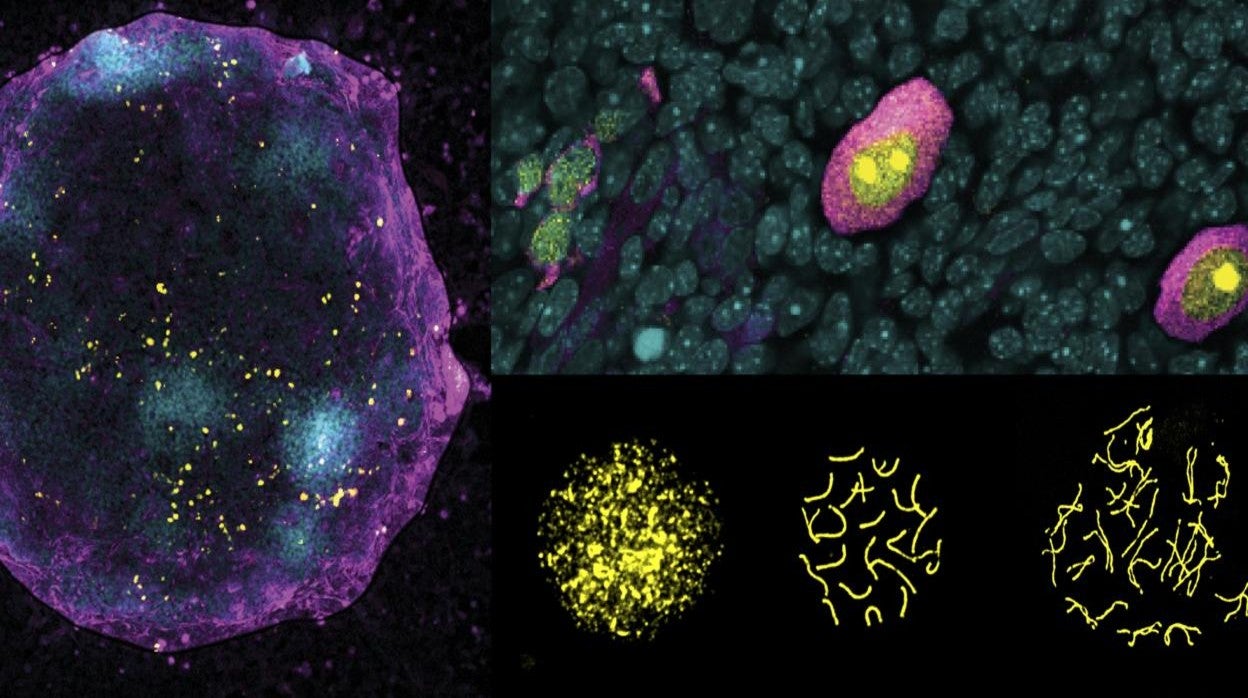
Un equipo científico del Centro de Regulación Genómica (CRG) de Barcelona ha identificado un posible marcador de diagnóstico que predice la eficacia del desarrollo de los óvulos mamíferos. Los hallazgos podrían allanar el camino para generar ovocitos artificiales en el laboratorio , algo que contribuiría a la investigación de las causas y tratamientos de los trastornos de infertilidad y probaría el impacto de fármacos o de productos químicos en la reproducción humana. El estudio se publica en la revista científica The EMBO Journal.
Los humanos tienen 23 pares de cromosomas . Los hombres y las mujeres compartimos 22 de los pares, y los dos que componen el vigésimo tercer par son los cromosomas sexuales. Los hombres suelen tener un cromosoma X y uno Y, mientras que las mujeres tienen dos X. Esto presenta un desafío para la maquinaria celular femenina, ya que tener dos cromosomas X activos genera una sobredosis de productos génicos , un factor mortal para los embriones en desarrollo o un factor carcinógeno para adultos. Para evitar este escenario, las células femeninas inactivan uno de los dos cromosomas X, apagando sus genes y compactándolo.
Se sabe muy poco sobre el impacto que tiene la inactivación del cromosoma X sobre el desarrollo de las células reproductivas. En los mamíferos, los ovocitos se desarrollan a partir de células germinales, células precursoras que migran desde el tejido embrionario hasta las gónadas, que están en la etapa temprana de desarrollo. Aquí las células germinales se dividen por meiosis , un importante proceso de reordenamiento cromosómico que es responsable de la singularidad genética de cada célula germinal. Las células germinales maduran y finalmente se convierten en espermatozoides u ovocitos funcionales.
Esto que contribuiría a la investigación de las causas y tratamientos de los trastornos de infertilidad y probaría el impacto de fármacos o de productos químicos en la reproducción humana
Para abordar esta pregunta, un equipo científico del Centro de Regulación Genómica (CRG) construyó un sistema de seguimiento del cromosoma X (XRep), una herramienta que les permitió estudiar cómo cambia la forma del cromosoma en tiempo real durante el desarrollo de células germinales in vitro.
Usando células de ratón hembra, el método reveló un acto cuidadosamente orquestado de "yoyo" en el cromosoma X. Si un cromosoma X previamente inactivado se reactivaba, las células germinales eran cuatro veces más eficientes para entrar en la fase de meiosis y transformarse en óvulos en comparación con las células germinales que nunca habían vuelto a "apagar y encender" su cromosoma X.
El estudio también halló que las células con dos cromosomas X activos se dividían más rápido y revertían fácilmente a un estado de pluripotencia. Según los autores, esta característica es parecida a los tumores causadas por células germinales en humanos, que provienen de células germinales que se perdieron durante su migración a las gónadas, o las que no lograron diferenciarse adecuadamente una vez dentro de los testículos y los ovarios.
Por estas razones, el equipo científico dedujo que la secuencia correcta de inactivación y reactivación del cromosoma X es un indicador de la diferenciación normal de las células germinales. El equipo de investigación señala que se necesitarán más estudios para confirmar si un estado anormal del cromosoma X es un indicador de diagnóstico o si podría ser un factor causal responsable de la anomalía celular.
El equipo de investigación señala que se necesitarán más estudios para confirmar si un estado anormal del cromosoma X es un indicador de diagnóstico o si podría ser un factor causal responsable de la anomalía celular.
«Nuestros hallazgos tienen implicaciones importantes para la investigación reproductiva porque XRep nos permite evaluar el estado del cromosoma X celular en tiempo real, lo que ayuda a identificar y aislar las células germinales que tengan una gran probabilidad de convertirse en ovocitos», dice Bernhard Payer, jefe de grupo en el CRG y autor principal del estudio.
«Los ovocitos humanos nunca se han generado completamente in vitro. Por lo tanto, la monitorización del estado del cromosoma X durante la diferenciación de células germinales in vitro podría ser una forma de optimizar el protocolo para producir óvulos humanos de alta calidad en el laboratorio.
Los óvulos humanos destinados a la investigación son escasos y difíciles de conseguir porque actualmente su disponibilidad depende de las donantes y se utilizan principalmente para fines reproductivos.
Por lo tanto, los óvulos humanos generados in vitro podrían proporcionar un recurso ilimitado para estudiar las causas y los tratamientos de los trastornos de infertilidad y también para probar la seguridad de los fármacos o productos químicos para la reproducción humana», concluye Payer.
Moritz Baue r, coautor del estudio, agrega: «Nuestros resultados también resaltan la necesidad de herramientas específicas para estudiar las células femeninas . La gran mayoría de los estudios se realizan con células masculinas, lo que genera una brecha de género en el conocimiento científico. Por lo tanto, debemos dejar de mirar el desarrollo femenino a través de la lente de las células masculinas , lo que contribuirá a la comprensión de las progresiones de las enfermedades específicas de cada sexo».
Noticias relacionadas